

臻格生物热烈祝贺丹码生物首个管线研发产品DM919泛瘤种适应症检查点抑制剂单抗,获得中国国家药品监督管理局 (NMPA) 中国药品审评中心CDE批准开展临床I期试验(CXSL2400035)。该管线已于2023年12月21日获得美国食品药品监督管理局(FDA)正式批准(NCT06328673)。
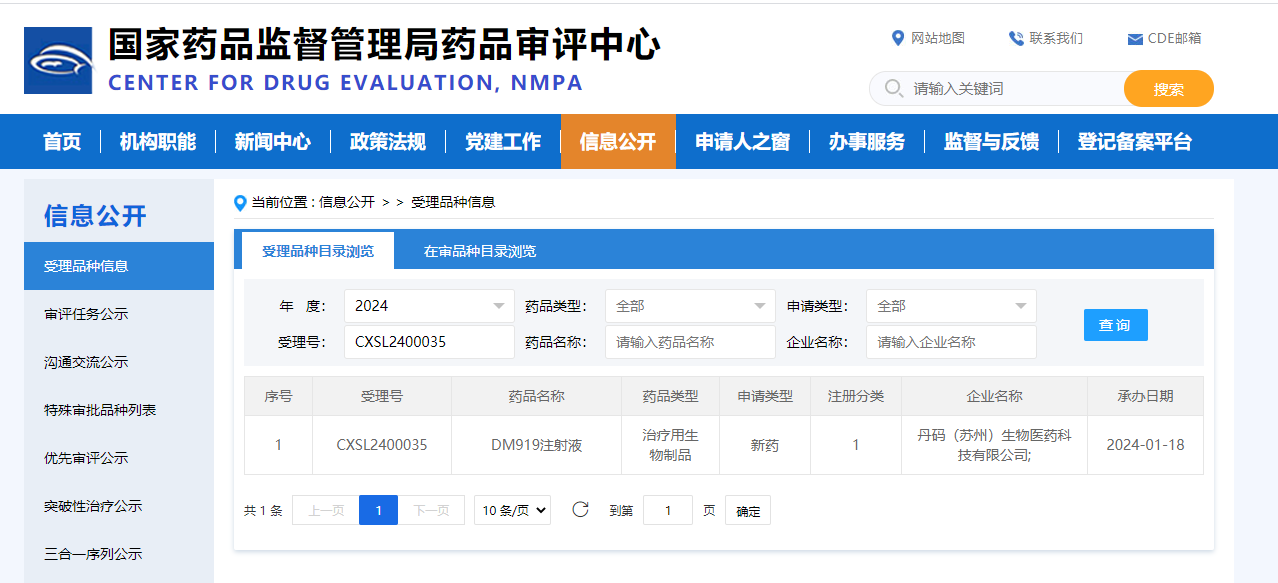
(CDE官网截图)
DM919靶向于一个全新与PD-1互补的免疫机制,有望在传统上的anti-PD1疗效差的MHC-I低表达肿瘤中体现良好的单药效果,并在与anti-PD-1联用上进一步提高肿瘤免疫的疗效。
臻格生物有幸成为丹码生物抗体CMC服务供应商,提供了从序列到IND的CMC服务,助力丹码生物新药项目IND获批。
臻格生物衷心地祝愿项目临床进展顺利,早日上市,惠及患者。臻格生物将始终坚持为全球合作伙伴,提供高质量、高效地全方位CDMO服务。